Rolle der Neutrophilen NETs in entzündlichen Erkrankungen
Leitung: Prof. Dr. rer. nat. Dr. med. habil. Martin Herrmann
Wir sind daran interessiert, die Rolle der Neutrophilen extrazellulären Fallen (NETs) in der Pathogenese entzündlicher Krankheiten zu verstehen. NETs sind dekondensierte Chromatinfäden, die neutrophile Granulozyten nach diversen Stimulationen aus ihren Kernen herausschleudern. NETs können Pathogene immobilisieren und so deren Ausbreitung im Gesamtorganismus verhindern. Andererseits sind NETs auch an vielen Pathologien beteiligt. Sie können die Blutgefäße, insbesondere die Kapillaren des Endstromgebiets, sowie die Gänge exokriner Drüsen verstopfen. Das kann zu chronischen Entzündungen führen. Da NETs auf ihren Oberflächen viele Enzyme und andere Proteine tragen, können sie viele wichtige Reaktionen beeinflussen.
Quelle: Uni-Klinikum Erlangen
- NETs in bakteriellen Infektionen und Mukosen
NETs sind an einer Vielzahl bakterieller Infektionserkrankungen beteiligt. Sie werden unter anderem durch Triggern des TLR4 mit LPS und diversen anderen TLR-Liganden sowie Triggern des FcgR mit Immunkomplexen induziert. Dabei ist die Bildung der NETs mit der enzymatischen Synthese reaktiven Sauerstoffs (ROS) und der Bindung granulärer Enzyme an das massive dekondensierte Chromatin verknüpft. NETs sind somit überzellgroße Bioreaktoren. In gesunden haben sie eine kurze Halbwertszeit, was Kollateralschäden vermindert. In diversen Krankheiten jedoch bleiben die NETs lange aktiv, was zum Beispiel zu einer unkontrollierten Proteolyse und dadurch zu Schäden an der extrazellulären Matrix führen kann, was wiederum die Funktionseinschränkung ganzer Organe verursacht. Wir untersuchen die NETs besonders auch in den Granulomen von Patienten mit Tuberkulose und in der Flüssigkeit aus Zahntaschen von Patienten mit Parodontose.
- NETs in Blutgefäßen
Im Steady-State bilden nur sehr wenige Neutrophile intravasale NETs, die leicht von den zirkulierenden Nukleasen DNase-1 und DNase1L3 gespalten und dann in der Leber abgebaut werden. Nach starker Aktivierung des Immunsystems, wie sie zum Beispiel bei septischen Krankheitsbildern zu finden ist, kann es zu einer massiven unkontrollierten NETs-Bildung kommen. Das überfordert die zirkulierenden Nukleasen und kann zum Verstopfen der Blutgefäße führen. Diese Immunthromben unterscheiden sich deutlich von den kanonischen Thromben. Wir untersuchen derzeit den Metabolismus der Fibrin-NET-Komplexe und setzen dazu Material ein, das bei Operationen entfernt wurde sowie in vitro generierte Immunthromben.
- NETs in den Gängen exokriner Drüsen
Die Gänge exogener Drüsen werden auch von Neutrophilen überwacht. Sie wandern in das beerenförmige, sekretorische Endstück der Drüsen, den sog. Azinus, ein und werden dann passiv im Sekret zur Gangmündung transportiert. Da viele Sekrete hohe Konzentrationen an Bicarbonat enthalten, bilden die Neutrophilen NETs. Sie binden retrograd eingedrungene Pathogene und transportieren diese mit dem Sekretfluss zur Mündung. Unter entzündlichen Bedingungen kann es zum Einwandern großer Mengen Neutrophiler kommen, deren NETs aggregieren und die Gänge verstopfen. Auf diesem Feld bearbeiten wir Speicheldrüse, Tränendrüse, Meibom-Drüse, Pankreas und die Galle.
- NETs in Patienten mit COVID-19
In Schnitten aus Autopsiematerial beobachteten wir eine Vielzahl verstopfter Blutgefäße sehr unterschiedlicher Größe. Es waren sowohl Kapillaren als auch größere Gefäße betroffen. Diese untypischen, durch Neutrophile induzierten Thromben können mit kanonischer Antikoagulation, wie sie auf Intensivstationen eingesetzt wird, nicht verhindert werden. Sie reagieren nur ungenügend auf das Lysesystem. Derzeit untersuchen wir die Mechanismen, wie diese Immunthromben ausgelöst werden, die ursächlich mit einem schweren Krankheitsverlauf zusammenhängen.
- Ektopische Kalzifikation
DNA ist ein wesentlicher Bestandteil der NETs. Sie hat ein Zucker-Phosphat-Rückgrat, das aus hochrepetitiven Phosphatgruppen besteht, die monovalent Ca++ binden und so einen mikroskopisch kleinen Keim für die Entstehung von Hydroxyapatit bilden können. Dieser Keim kann durch weitere Anlagerungen von Ca++ und PO43-- wachsen und schließlich sichtbare Kristallaggregate bilden. Wir untersuchen derzeit die Faktoren, die die ektopische Bioverkalkung vorantreiben bzw. inhibieren. Dabei analysieren wir sowohl Weichteilverkalkungen, wie zum Beispiel Calcinosis cutis, als auch die Entstehung von Steinen in der Galle, im Pankreas und in der Niere.
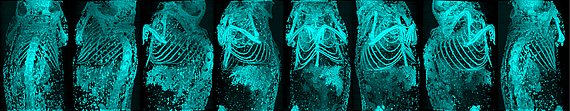
- Nachweis verstopfter Kapillaren über endogene Fluoreszenz
In der Fluorezenzmikroskopie beobachteten wir, dass ungefärbte Kapillaren in Gewebebiopsien, bei Anregung mit 488nm, ein starkes Signal bei 520nm aussenden, wenn sie verstopft sind. So lassen sich diese pathologisch wichtigen Okklusionen des Endstromgebiets leicht nachweisen und eindeutig von gesunden, offenen Kapillaren abgrenzen.
- Agonistische Antikörper gegen G-gekoppelte Rezeptoren
In diversen Krankheiten treten Autoantikörper auf, die permanent und unreguliert G-Protein gekoppelte Rezeptoren stimulieren und so stark in wichtige Regelkreise des Organismus eingreifen. So ist zum Beispiel die dilatative Kardiomyopathie mit Antikörpern gegen den β1 adrenergen Rezeptor assoziiert. Es gilt als sicher, dass sie das Krankheitsgeschehen beeinflussen oder sogar auslösen können. Derzeit untersuchen wir die agonistischen Autoantikörper in Patienten mit COVID-19 und deren Beteiligung am Krankheitsbild „Long COVID“.
| Martin Herrmann | Arbeitsgruppenleiter |
| Jasmin Knopf | Postdoktorandin |
| Sami Hosari | Postdoktorand |
| Lei Liu | Postdoktorand |
| Irmgard Herrmann | Bildbearbeitung |
| Jeeshan Singh | naturwissenschaftliche Doktorandin |
| Leticija Zlatar | naturwissenschaftliche Doktorandin |
| Han Wang | medizinische Doktorandin |
| Maximilian Dölling | medizinischer Doktorand |
| Daniel Hosari | medizinischer Doktorand |
Deutsche Forschungsgemeinschaft (DFG)
FOR 2886 - PANDORA "Natrium-abhängige Gewebeosmolarität in der Kontrolle der rheumatoiden Arthritis" (2022-2025)
SFB/TRR 241 "Notfallbarrieren – Neutrophilen-Netze (NETs) und deren Interaktion mit intestinalem Epithel" (2018-2022)
SFB 1181 "Amplification of NET formation and neutrophil aggregation for the resolution of inflammation." (2019-2023)
European Commission
ERC Grant "NeutroCure - Development of “smart” amplifiers of reactive oxygen species specific to aberrant polymorphonuclear neutrophils for treatment of inflammatory and autoimmune diseases, cancer and myeloablation." (2020-2024)
- Leppkes M, Knopf J, Naschberger E, Lindemann A, Singh J, Herrmann I, Stürzl M, Staats L, Mahajan A, Schauer C, Kremer AN, Völkl S, Amann K, Evert K, Falkeis C, Wehrfritz A, Rieker RJ, Hartmann A, Kremer AE, Neurath MF, Muñoz LE, Schett G, Herrmann M. (2020) Vascular occlusion by neutrophil extracellular traps in COVID-19. EBioMedicine. 58:102925.
- Muñoz LE, Boeltz S, Bilyy R, Schauer C, Mahajan A, Widulin N, Grüneboom A, Herrmann I, Boada E, Rauh M, Krenn V, Biermann MHC, Podolska MJ, Hahn J, Knopf J, Maueröder C, Paryzhak S, Dumych T, Zhao Y, Neurath MF, Hoffmann MH, Fuchs TA, Leppkes M, Schett G, Herrmann M. (2019) Neutrophil extracellular traps initiate gallstone formation. Immunity. 51(3):443-450.e4.
- Boeltz S, Amini P, Anders HJ, Andrade F, Bilyy R, Chatfield S, Cichon I, Clancy DM, Desai J, Dumych T, Dwivedi N, Gordon RA, Hahn J, Hidalgo A, Hoffmann MH, Kaplan MJ, Knight JS, Kolaczkowska E, Kubes P, Leppkes M, Manfredi AA, Martin SJ, Maueröder C, Maugeri N, Mitroulis I, Munoz LE, Nakazawa D, Neeli I, Nizet V, Pieterse E, Radic MZ, Reinwald C, Ritis K, Rovere-Querini P, Santocki M, Schauer C, Schett G, Shlomchik MJ, Simon HU, Skendros P, Stojkov D, Vandenabeele P, Berghe TV, van der Vlag J, Vitkov L, von Köckritz-Blickwede M, Yousefi S, Zarbock A, Herrmann M. (2019) To NET or not to NET: current opinions and state of the science regarding the formation of neutrophil extracellular traps. Cell Death Differ. 26(3):395-408.
- Jiménez-Alcázar M, Rangaswamy C, Panda R, Bitterling J, Simsek YJ, Long AT, Bilyy R, Krenn V, Renné C, Renné T, Kluge S, Panzer U, Mizuta R, Mannherz HG, Kitamura D, Herrmann M, Napirei M, Fuchs TA. (2017) Host DNases prevent vascular occlusion by neutrophil extracellular traps. Science. 358(6367):1202-1206.
- Rauber S, Luber M, Weber S, Maul L, Soare A, Wohlfahrt T, Lin NY, Dietel K, Bozec A, Herrmann M, Kaplan MH, Weigmann B, Zaiss MM, Fearon U, Veale DJ, Cañete JD, Distler O, Rivellese F, Pitzalis C, Neurath MF, McKenzie ANJ, Wirtz S, Schett G, Distler JHW, Ramming A. (2017) Resolution of inflammation by interleukin-9-producing type 2 innate lymphoid cells. Nat Med. 23(8):938-944.
- Pfeifle R, Rothe T, Ipseiz N, Scherer HU, Culemann S, Harre U, Ackermann JA, Seefried M, Kleyer A, Uderhardt S, Haugg B, Hueber AJ, Daum P, Heidkamp GF, Ge C, Böhm S, Lux A, Schuh W, Magorivska I, Nandakumar KS, Lönnblom E, Becker C, Dudziak D, Wuhrer M, Rombouts Y, Koeleman CA, Toes R, Winkler TH, Holmdahl R, Herrmann M, Blüml S, Nimmerjahn F, Schett G, Krönke G. (2017) Regulation of autoantibody activity by the IL-23-TH17 axis determines the onset of autoimmune disease. Nat Immunol. 18(1):104-113
- Muñoz LE, Bilyy R, Biermann MH, Kienhöfer D, Maueröder C, Hahn J, Brauner JM, Weidner D, Chen J, Scharin-Mehlmann M, Janko C, Friedrich RP, Mielenz D, Dumych T, Lootsik MD, Schauer C, Schett G, Hoffmann M, Zhao Y, Herrmann M. (2016) Nanoparticles size-dependently initiate self-limiting NETosis-driven inflammation. Proc Natl Acad Sci U S A. 113(40):E5856-E5865.
- Leppkes M, Maueröder C, Hirth S, Nowecki S, Günther C, Billmeier U, Paulus S, Biermann M, Munoz LE, Hoffmann M, Wildner D, Croxford AL, Waisman A, Mowen K, Jenne DE, Krenn V, Mayerle J, Lerch MM, Schett G, Wirtz S, Neurath MF, Herrmann M*, Becker C*. (2016) Externalized decondensed neutrophil chromatin occludes pancreatic ducts and drives pancreatitis. Nat Commun. 7:10973. *shared senior authorship
- Harre U, Lang SC, Pfeifle R, Rombouts Y, Frühbeißer S, Amara K, Bang H, Lux A, Koeleman CA, Baum W, Dietel K, Gröhn F, Malmström V, Klareskog L, Krönke G, Kocijan R, Nimmerjahn F, Toes RE, Herrmann M, Scherer HU, Schett G. (2015) Glycosylation of immunoglobulin G determines osteoclast differentiation and bone loss. Nat Commun. 6:6651.
- Schauer C, Janko C, Munoz LE, Zhao Y, Kienhöfer D, Frey B, Lell M, Manger B, Rech J, Naschberger E, Holmdahl R, Krenn V, Harrer T, Jeremic I, Bilyy R, Schett G, Hoffmann M, Herrmann M. (2014) Aggregated neutrophil extracellular traps limit inflammation by degrading cytokines and chemokines. Nat Med. 20(5):511-7.
PubMed-Publikationsliste von Prof. Dr. Martin Herrmann
